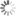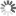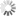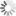Ein „Katalysator“ für die Medizin von morgen
Tobias Ritter erhält am 1. November für seine innovative Fluor-Forschung den Klung-Wilhelmy-Weberbank-Preis
31.10.2012
Bringt Fluor und Kohlenstoff zusammen: Der Chemiker Tobias Ritter forscht und lehrt in Harvard. Seine Arbeit über Fluorierungsmethoden ist von großer Bedeutung für die Diagnose und Therapie von Krankheiten wie Krebs.
Bildquelle: Rose Lincoln
Es gibt Preise, die sind fast ein Muss für jemanden, der an der Harvard-Universität in Boston forscht. „Das wird erwartet, da ist man erleichtert, wenn man sie – endlich – bekommt“, meint Professor Tobias Ritter. „Aber mit anderen rechnet man nicht, weil sie herausragend sind und so selten.“ Dass er nun einen dieser seltenen bekommt – den Klung-Wilhelmy-Weberbank-Preis – macht ihn stolz. Die Auszeichnung wird im jährlichen Wechsel an Chemiker und Physiker verliehen und gehört mit 75.000 Euro zu den höchst dotierten privat finanzierten Preisen für deutsche Nachwuchsforscher.
Ritter entwickelt mit seinem Team schnelle, milde Fluorierungsmethoden für biomedizinisch relevante Moleküle – und die passenden Katalysatoren dafür gleich mit. Moleküle, die Fluor enthalten, sind sehr gefragt. In den Materialwissenschaften als Basis für Kunststoffe, wie etwa Teflon, in der Chemischen Industrie unter anderem als Lösungsmittel. Regelrecht lebenswichtig sind sie inzwischen in der Medizin. Wirkstoffmoleküle, die ein Fluor-Atom tragen, sind fettlöslicher und werden damit langsamer abgebaut im Körper. Fluor macht Medikamente somit wirksamer. Bereits jedes fünfte Präparat auf dem Markt enthält mittlerweile mindestens ein Atom davon.
Seine Forschung ebnet den Weg für wirksamere Arzneimittel
Auch aus der Diagnostik ist das Element inzwischen nicht mehr wegzudenken. Bei der Suche nach Tumoren mittels Positronen-Emissions-Tomographie (PET), einem bildgebenden Verfahren in der Nuklearmedizin, wird jedes Jahr millionenfach radioaktive Fluordesoxy-Glucose (FDG) als Biomarker eingesetzt. Krebszellen haben einen erhöhten Stoffwechsel, verbrauchen mehr Zucker als gesundes Gewebe und nehmen also auch mehr von der radioaktiven Glucose auf. Mithilfe des PET-Scan wird sichtbar, an welchen Stellen im Körper sich die Glucose angereichert hat und damit möglicherweise ein Tumor sitzt.
„Interessant wären auch PET-Radiopharmaka, die sich als Biomarker für andere Zwecke einsetzen lassen. Zum Beispiel für Alzheimer, Parkinson oder Schizophrenie.“ Tobias Ritter arbeitet bereits an Molekülen, die im Gehirn an Rezeptoren binden können und so Hinweise auf neurologische Erkrankungen geben.
Doch entsprechende organische Moleküle gezielt mit Fluor-Atomen anzureichern, war bisher schwierig. Fluor (F), das Halogen mit dem kleinsten Atomradius, ist heikel im Umgang. Es ist sehr reaktionsfreudig, schwer kontrollierbar und seine Bindungen zu anderen Elementen sind extrem polar. Ein kleines Kraftpaket, das in einem organischen Molekül das Elektronenpaar zwischen sich und dem benachbarten Kohlenstoffatom (C) förmlich an sich reißt.
„Um eine F-C-Bindung zu knüpfen oder zu brechen, ist deshalb sehr viel Aktivierungsenergie nötig“, erklärt Ritter. Das bedeutete bisher so drastische Reaktionsbedingungen, dass komplexere organische Moleküle es meist nicht „überlebten“. Zudem können PET-Radiopharmaka, weil hier das kurzlebige Radionuklid Fluor-18 eingesetzt wird, erst kurz vor der Anwendung am Patienten fluoriert werden.
Ritter fand nun einen schonenden Weg, Fluor und Kohlenstoff zusammenzubringen. Der 37-Jährige entwickelte dafür sogenannte bi-nukleare Organometall-Katalysatoren mit zwei Palladium-Atomen. Diese sorgen dafür, dass für die Bindung des Fluor-Atoms deutlich weniger Aktivierungsenergie benötigt wird.
Das Fluor-Atom kann nun viel leichter und schneller auf die gewünschten Moleküle übertragen werden. Ritter ebnete damit den Weg für wirksamere Medikamente und eine neue Generation von radioaktiv markierten Stoffen zum Einsatz als Biomarker bei PET-Untersuchungen.
Lehre hat hohen Stellenwert
Um seine Forschung tatsächlich anzuwenden, bedarf es für Ritter heute nur weniger Schritte. Seit 2010 ist er nicht nur Associate Professor in Harvard, sondern auch assoziierter Chemiker im Department für Radiologie am benachbarten Massachusetts General Hospital. „Wir können morgens bei uns im Labor ein Molekül herstellen und nachmittags drüben, kurz vor dem PET-Scan, Fluor-18 anhängen.“ Einen ersten eigenen Biomarker zur Erkennung von Depressionen testet er dort derzeit im Tierversuch.
Neben der Forschung hat die Lehre für Tobias Ritter einen hohen Stellenwert. „Die Chemie hat sich in den letzten 20 Jahren rasant verändert. Damit muss die Lehre Schritt halten. Sie zu modernisieren, dazu möchte ich beitragen.“ Unterrichten kann er selbst ausgezeichnet. Dafür spricht neben dem Feedback seiner Studenten auch der Roslyn Abramson Award for Excellence in Teaching, den er 2010 erhielt. Ein weiterer seltener Preis, mit dem er nie gerechnet hat. Am 1. November müssen seine Studenten auf ihn verzichten. Ausnahmsweise. Denn da ist Tobias Ritter in Berlin.
Verleihung des Klung-Wilhelmy-Weberbank-Preises
|