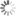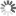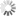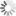Wanderung durch die Zellmembran
Interdisziplinäres Forschungsteam der Freien Universität entwickelt neue Technik zur Beobachtung der Organisation der Zellmembran
Nr. 145/2020 vom 27.08.2020
Eine interdisziplinäre Forschungsgruppe des Instituts für Chemie und Biochemie der Freien Universität Berlin hat die nanoskopische Organisation der Zellmembran untersucht. In ihrer Studie beschreiben die Wissenschaftlerinnen und Wissenschaftler der Chemie und Biochemie um Doktorandin Jia Hui Li eine neue Methode, mit der sich Membranproteine gezielt durch die Plasmamembran bewegen lassen, während ihre Position nanometergenau dargestellt wird. Dafür nutzen die Forscherinnen und Forscher winzige magnetische Partikel, die im Fluoreszenzmikroskop sichtbar sind, und koppelten sie an Proteine, die in der Zellmembran gelöst waren, sogenannte Membranproteine. Mithilfe von Magneten konnten sie die Nanopartikel und damit die Proteine über die Zelloberfläche ziehen, bis ein Hindernis die Bewegung stoppte. Das Hindernis wurde dann mittels hochauflösender Mikroskopie genauesten kartographiert. Diese Technik soll es ermöglichen, ein besseres Verständnis der Organisation der Zellmembran zu erreichen. Die Studie erschien in der renommierten Fachzeitschrift Nature Communications.
Die Plasmamembran ist ein zweidimensionales, flüssiges Mosaik aus Lipiden und Proteinen. Einer Seifenblase ähnlich, umhüllt diese Milliardstel Meter dünne Schicht jede Zelle und kontrolliert den Austausch der Zelle mit ihrer Umgebung. So gelangen Nährstoffe mithilfe von Transportproteinen über die Zellmembrane in die Zelle. Botenstoffe beeinflussen die Zelle über Rezeptoren in der Membran, die Nachrichten ins Innere der Zelle weitertragen. Die Membranproteine sind oft nach unterschiedlichen Funktionen räumlich voneinander getrennt, zum Beispiel in Synapsen. Unklar ist bislang noch, wie Zellen die Verteilung der Proteine und Rezeptoren kontrollieren, die sich in dieser flüssigen Schicht frei bewegen können, um solche räumlichen Trennungen zu vereinfachen. Ziel der neu entwickelten Methode ist es, einen Beitrag zur Aufklärung derartiger Organisationsmechanismen der Plasmamembrane zu leisten.
In vorheriger Forschung hatte die Arbeitsgruppe des Biochemikers Prof. Dr. Helge Ewers von der Freien Universität, in der Frau Li arbeitet, bereits festgestellt, dass die Plasmamembran in den langgestreckten Fortsätzen von Nervenzellen, welche Signale von Zelle zu Zelle im Gehirn weiterleiten, durch ein direkt anliegendes Netzwerk in kleine Domänen aufgeteilt ist. Ungeklärt war jedoch, wo dieses Netzwerk an der Membran anliegt und wie genau es die Bewegung der Membranproteine beeinflusst. „Mit der neuen Technik wollen wir nun Proteine gezielt durch die Membran gegen dieses Netzwerk ziehen, um dessen genauen Ort und dessen Funktion besser zu verstehen“, erklärt Helge Ewers.
Eine große Stärker dabei sei die interdisziplinäre Zusammenarbeit der verschiedenen Disziplinen. „Zuerst wurde die Technik in künstlichen Membranen in Zusammenarbeit mit der Arbeitsgruppe von Dr. Stephan Block realisiert. Anschließend wurde das Vorgehen in Zellen nachempfunden“, sagt Helge Ewers. Der Biophysiker Stephan Block arbeitet an der experimentellen Darstellung und Messung von Kräften, die auf Membranproteine wirken. Mit diesem Ziel werden in seiner Arbeitsgruppe komplexe experimentellen Aufbauten mit mikrofluidischer Kanälen verwendet, die durch Flüssigkeitsströme einen Sog erzeugen, der auf die Membranproteine wirkt. „Leider waren diese Messungen mit Experimenten an Zellen nicht kompatibel. Dieses Problem wurde nun durch die von Frau Li entwickelte Methode elegant gelöst“, erklärt Helge Ewers. Die interdisziplinäre Zusammenarbeit, die zu diesem Erfolg führte, ist den beteiligten Wissenschaftlerinnen und Wissenschaftlern zufolge eine große Stärke ihres Fachbereiches.
Die Studie ist Teil der Sonderforschungsbereiche SFB 958 und TRR 186. Die Arbeit wurde vom Gerätezentrum BioSupramol unterstützt.
Pressefoto
Trajektorien hunderter fluoreszierender Partikel, die mittels eines Magneten über eine künstliche Membran gezogen werden. Schräg durch die Membrane geht ein Defekt, an dem die Partikel hängenbleiben. Die Position dieses Hindernisses kann so sehr genau gemessen werden.
Weitere Informationen
Publikation
Li, J. H., Santos-Otte, P., Au, B., Rentsch, J., Block, S., and Ewers, H. Directed manipulation of membrane proteins by fluorescent magnetic nanoparticles. Nat Comm. 11, DOI: 10.1038/s41467-020-18087-3 (2020).
Kontakt
Prof. Dr. Helge Ewers, Institut für Chemie und Biochemie an der Freien Universität Berlin, Telefon: 030 838-60644, E-Mail: helge.ewers@fu-berlin.de